文獻標識碼: A
DOI:10.16157/j.issn.0258-7998.171624
中文引用格式: 唐思源,苗玥,楊敏. CT影像中毛玻璃型肺結節提取方法的研究[J].電子技術應用,2018,44(2):109-114.
英文引用格式: Tang Siyuan,Miao Yue,Yang Min. GGO lung nodule extraction methods of CT images[J]. Application of Electronic Technique,2018,44(2):109-114.
0 引言
據統計,肺癌是癌癥病例中發病率較高的一類癌癥,但如果早期發現,可以極大地降低患者的死亡率。發現早期肺癌的主要方法是通過X射線或者CT發現病人病灶,X射線成像模糊,不易觀察病灶發展。目前都采用多層螺旋CT[1]或者磁共振成像(MRI)檢測肺癌,肺結節是肺癌在CT上的表現形式,通過詳細地分析并精確地檢測肺結節,可以提高肺癌早期診斷的準確率,并有著重要的臨床價值。
在肺結節的5種類型中,國內外研究最多的是實心型結節,包括孤立型、粘連血管型、粘連肺壁型三類[2]。而空洞型及毛玻璃型結節研究方法相對比較少,毛玻璃型肺結節與實心型結節相比,沒有固定的形狀、大小以及清晰的邊界,不易提取結節圖像的特征,很難通過一種有效的方法檢測并提取出肺結節。MAEKADO M[3]通過計算圖像的灰度值,繪制直方圖來提取毛玻璃型肺結節。KATSUMATA Y[4]用濾波器拉伸血管和結節的對比度,提取肺結節的特征,最后用神經網絡分類器識別出毛玻璃型結節。ZHOU J H[5]首先用圓點濾波器(Dot filter)去掉噪聲和周圍血管,然后提取紋理特征,最后用K-NN分類器識別毛玻璃型結節。
文獻[3]中通過濾波器增強GGO型肺結節的灰度值后,可以直接通過閾值法檢測GGO型結節。但是用濾波器增強GGO型結節對比度時,由于GGO型結節邊緣模糊,形態無規律,很容易漏檢,再用閾值法提取GGO型結節會把血管混淆進去,從而導致檢測的精確率下降。文獻[5]中用圓點濾波器只提取到了圓形的肺結節,漏掉了部分非圓形肺結節。本文在分析毛玻璃型結節特點的基礎上,對現有的研究方法進行改進,提出了一種檢測和提取毛玻璃型結節的新方法。基于形狀的濾波器能很好地提取部分具有球型形狀的GGO型結節,但會漏掉一部分無規則的GGO型結節。只用閾值法,檢測的準確率會下降;只用形狀濾波器,檢測的漏檢率會提高。把二者結合起來,與單獨使用閾值法或形狀濾波器方法相比,降低了假陽性,提高了檢測的準確率。
1 基于CT圖像的肺實質分割原理
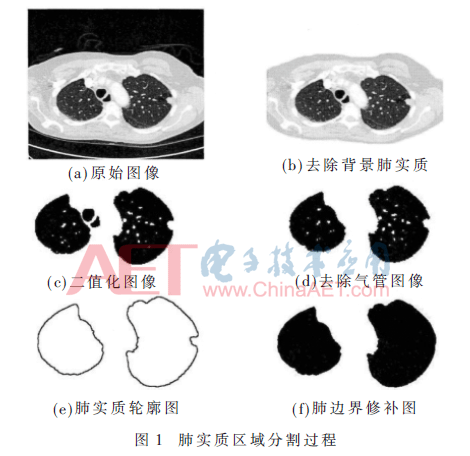
人體的組織器官是錯綜復雜并相互關聯的,首先要從組織器官中把肺部區域分割[6]出來,去掉肺實質周圍的氣管、噪聲等無關信息,如果有兩肺部粘連情況,還要對其進行分離。應用改進的閾值法區分肺部區域和背景,如果出現左右肺粘連情況時,通過基于分水嶺變換的分割方法分離左右肺區,最后對肺邊界進行修補。
首先,剔除背景,繪制肺部區域及周圍背景的灰度直方圖,找到峰谷,獲得初始分割閾值,對于背景和肺實質重疊區域,將多個峰谷應用迭代法進行修復,最終得到最佳閾值,再應用區域生長方法將背景從肺部區域中去除。其次,去掉氣管,肺實質外部及肺壁上含有的氣管、血管等管狀結構的器官,為了精確地提取肺部區域,本文提出一種改進的3D區域生長方法[7]去除外部管狀器官。如果左右肺有粘連,分離左右肺,首先定位粘連的肺部區域,然后再進行左右肺區的分割,最后再應用形態學運算調整分割誤差。最后,進行肺邊界的修補,在進行肺實質的初始分割后,肺邊界處表現出許多凹凸不平的現象,主要是由于有一些結節在肺部內邊緣或者粘連的外部區域,為了降低結節的漏檢率,本文利用滾球法和形態學操作修補肺邊界的缺口,將肺結節包含在肺實質中,得到平滑和完整的肺邊界。滾球法的原理[8]是設定一定半徑的圓形,利用邊界的曲率變化,圓形模板在肺邊界沿著指定方向滾動一圈,并回到初始位置,最后利用圓形模板對邊界進行形態學操作的過程。
2 肺實質分割算法及結果
2.1 背景剔除
背景剔除具體算法流程為:
(1)輸入影像信息,計算獲得CT圖像上X、Y軸方向的最大分辨率Amax、Bmax。
(2)計算初始閾值T,通過閾值把像素集分割成A、B兩個區域,計算兩個區域像素集的均值μa、μb,獲得最佳閾值:

(3)種子點的選擇,從圖像最左側出發,設定四鄰域模板,掃描周圍像素點,如果像素點的灰度值小于Tz,則為種子點。
(4)初始參數設定:Tz=-400 HU,Plefttop=(1,1),Prighttop=(1,Bmax),Pleftdown=(Amax,1),Prightdown=(Amax,Bmax)。
(5)設定區域生長規則:其中I(Ai,Bi)為原始圖像的任意像素值,N4(Ai,Bi)是Ai、Bi的四領域像素點。

從左上到右下所有圖像的所有區域,找出滿足式(2)、式(3)的所有像素點。
(6)應用區域生長算法對所有種子點的四鄰域像素進行搜索,直到不滿足條件為止。
(7)將滿足搜索條件的背景區域設置成白色,對圖像進行二值化操作。
2.2 去掉氣管
提取肺實質外部氣管的算法思想是:設定種子點后,應用棋盤距離標記方法生成區域內的像素,確定好棋盤間的距離K,經過第N次迭代后,依據區域生長規則,搜索滿足條件的所有像素點,最后設置生長終止條件,檢測到氣管區域。設V(K)為滿足區域生長的面積值,繪制V(K)值的曲線變化圖,觀察曲線圖中值的變化,如果數值突然變大,表明檢測到管狀器官,提取并去掉該區域,具體步驟如下:
(1)種子點的選擇:從中肺野層片上開始搜索種子點,設定4×4模板,搜索所有滿足像素點的區域,利用區域生長法獲得種子點。
(2)生長規則:搜索種子點周圍6領域像素的值,保留T+6與T-6之間的像素值,搜索不少于100個像素的面積區域。
(3)終止條件:計算函數V(K)的面積導數,如果面積導數值大于零,則停止搜索,提取氣管區域,獲得肺實質。
2.3 左右肺分離
剔除背景及氣管后,有的肺部CT圖像中的左右肺是粘連在一起的,能精確地分離出左右肺是檢測結節的前提。具體算法過程如下所示:
(1)定位感興趣區域:首先應用投影法[9],公式如下:

計算像素點的積分值,應用積分值確定像素點的坐標S(x0,y0)后,以坐標點為中心,確定半徑R,得到一個矩形區域,該區域即為左右肺相連的區域。
(2)左右肺分割:用0和1值對待分割的矩形區域進行標記,然后計算像素的梯度幅度,求出極值,根據極值設定“分水嶺”,用山脊來表示雙肺區域,用山谷表示雙肺間縱膈區,最后用山谷的極值來分割左右肺區。對分割的左右肺進行二值化處理及顏色的反轉。
(3)腐蝕膨脹方法精確分割區域:由于左右肺連接處結構復雜、形態多樣,本文應用形態學方法對內外分組區域的像素點進行調整。通過對連接部件的分析,不斷調整形態學算子的初始半徑r0,對矩形區域進行腐蝕和膨脹運算,直到完全并精確地分割左右肺區。
2.4 肺邊界修補
滾球法的算法步驟:
(1)分別提取左右肺部區域圖像,對其進行邊界修復;
(2)通過大量的實驗數據獲得合理的圓形半徑,應用圓形模板在邊界滾動,修補邊界的凹陷處;
(3)應用基于局部區域的滾球法提高圖像處理速度,縮小形態學操作的范圍,減少運行時間。
2.5 肺實質仿真分割結果
實驗數據來源于美國LIDC(Lung Imaging Database Consortium)肺影像數據庫,按照本文的方法對非粘連左右肺區采用的分割步驟,獲得的處理結果如圖1所示。
3 基于形狀特征和濾波增強法的GGO型結節檢測
GGO型結節的形態特征表現為模糊的稀薄影,與實心型結節相比,形狀不規則、邊界不清晰。但部分GGO型結節的局部結構都是類球型的,很多無規則形狀的GGO型結節都是由這些類球型局部結構組成的。分析了結節的特點后,先提取球型結構的GGO型結節,然后再用濾波增強后的閾值法提取剩余結節,該方法與單獨使用一種方法相比,降低了漏檢率,假陽率也有所下降。
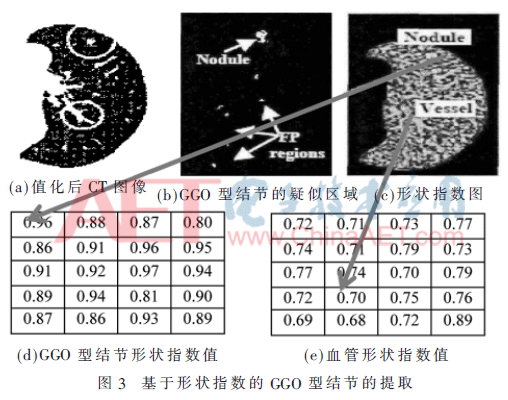
3.1 形狀指數的定義
形狀指數(shape Index)[10]、CT值和曲率可以表示像素的局部特征。形狀指數的值表示了與球型的接近比例。大部分肺結節表現出類球型結構,而血管是類管狀結構,通過形狀指數數值的差異,可以區分并提取出肺結節。形狀指數是由曲率以及導數運算計算得出。設K(s)、H(s)為像素s的高斯曲率值和平均曲率值,可得公式:
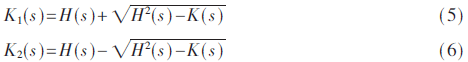
通過K1(s)、K2(s)計算得出像素s的主曲率,最后推導出形狀指數的值為:

表1給出了5種形狀指數值及對應的形狀說明。

3.2 基于形狀特征的GGO型結節的提取
目前,檢測實心型肺結節常用的方法有濾波增強法、圓點濾波器法等,但對于低密度的GGO型結節,由于邊界模糊,直接應用濾波增強法不能精確地檢測和提取肺結節,部分GGO型結節也是由局部類球型的小肺結節組成的。因此,利用形狀指數特征區分具有球型特征的GGO型結節和血管是實際可行的。
下面給出應用形狀特征提取疑似GGO型結節區域的處理過程,設i、j為所選區域Rs任意像素值,Vi、Vj為接近球型的經驗閾值,閾值的取值范圍在0.8~1.0之間,本文設定Vi=0.91,Vj=0.88。定義SI(i)、SI(j)為像素i、j的形狀指數,對應的公式有:

(1)在Rs區域內,提取滿足式(8)的i像素,以及i像素周圍四鄰域的連通區域Rsi。
(2)在Rs區域內,提取滿足式(9)的j像素,以及j像素周圍八鄰域的連通區域Rsj。
(3)如果Rsj區域至少包含Rsi區域內的一個連通區域,則Rsi即為疑似候選區域。
(4)定位候選區域后,應用公式:

其中,fM為Rsi區域的CT均值,通過式(10)、式(11)計算候選區域密度的最大值fTH、最小值fTL,應用自適應閾值法對Rsi區域進行分割,提取出類球型的GGO型肺結節。
在生成的形狀指數圖上,數值在0.8~1.0之間是類球型,0.5~0.75之間的是類管狀型,通過數值可以提取出類球型的GGO型肺結節。
3.3 基于自適應非線性濾波器GGO型肺結節的提取
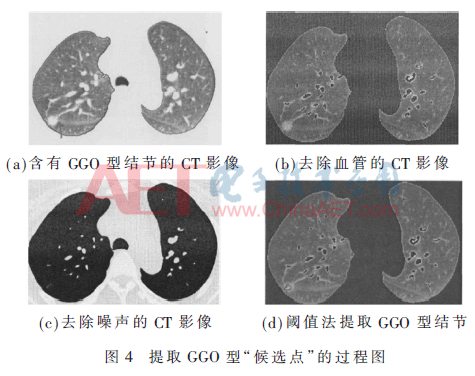
利用形狀指數特征可以提取具有類球型結構的GGO型肺結節,但部分非球型結構的結節還混淆在肺實質里,為了降低漏檢率,在第二階段通過自適應非線性濾波器(Adaptive Nonlinear filter,AN filter)[11]拉伸肺實質與肺結節的對比度,去除噪聲后,用閾值法提取剩余的非球型的肺結節,提取結節步驟:
(1)去除候選區域內的血管:計算候選結節區域內像素的形狀指數值,由表1可知,血管的形狀指數值在0.5~0.75之間,設閾值T=0.75,應用閾值法,提取閾值為0.75的像素,組成的像素集就為候選區域內的血管。
(2)剔除類球型肺結節:應用第一階段形狀指數特征檢測出類球型肺結節,圖像二值化后,去除該類型的結節,保留肺實質及部分非球型肺結節。
(3)應用AN filter濾波器區分肺結節:由于肺實質與肺結節的CT像素密度值比較接近,通過非線性濾波器拉伸肺實質與肺結節的對比度。設自適應濾波器模板S的大小為k1×k2,用模板系數mij表示像素(x,y)與像素(x+i,y+j)灰度值之間的相似程度,如果相似程度相似,則mij=1,否則mij=0。模板S的大小及模板系數mij的公式表達如下所示:

為了使濾波器的效果更好,把高通濾波器gH(x,y)與低通濾波器gL(x,y)相結合,card(S)表示集合S的個數,公式表示如下:

(4)去除圖像噪聲:利用多尺度的高斯函數去除圖像的噪聲,對圖像進行平滑處理,設結節大小的取值范圍為[r0,r1],目前檢測的肺結節大小通常介于3 mm~30 mm之間,高斯函數中尺寸參數σ的值應該為[r0/3,r1/3],具體計算σ值的流程為:

(5)閾值法提取肺結節:繪制候選區域圖像的灰度分布圖,計算得出閾值T的值,利用估計閾值法分割并提取非球型肺結節。
4 GGO型結節特征提取原理
得到分割后的肺結節區域后,由于肺部結構的復雜,在肺結節內包含部分假陽性結節,即血管或氣管及噪聲等。對肺結節的特征進行定性和定量的分析,并提取結節的特征,可以更精確地區分出肺結節,提高了檢測結節的準確率,也降低假陽率。目前,肺結節的特征有形狀、灰度、位置等三大類。本文主要在結節的大小、外部形狀、內部特征[12]等方面進行特征提取,通過對提取出的特征進行合理的排列,選擇一組最佳的特征組合,放入分類器中提取并識別肺結節。具體的特征如下:
4.1 形狀特征
為了反應結節的形狀、大小等方面的差異性,本文計算的形狀特征值有如下幾個,其中I表示像素數,C1表示結節區域內接圓的面積,C0表示結節區域外接圓的面積,R是結節區域的長軸與短軸形成的矩形。
(1)面積A:

4.2 灰度特征
灰度特征統計了圖像中像素點灰度值的分布情況,本文主要提取肺結節中以下幾個灰度特征值,其中面積Cx表示結節包含的像素數,I(x,y)表示每個像素點的灰度值。
(1)灰度平均值Mx:

4.3 位置特征
位置特征反應肺結節在肺區域內所處的位置信息,本文主要提取中心距、中心角兩個位置特征,(xp,yp)表示肺結節質心p的坐標值,(xo,yo)表示肺實質質心o的坐標值。中心距EU表示p與o的歐式距離。中心角AX表示質心p對肺實質質心o的輻角,令![]() (0≤
(0≤![]() ≤2π)為op與x軸的夾角。
≤2π)為op與x軸的夾角。
(1)中心距EU:
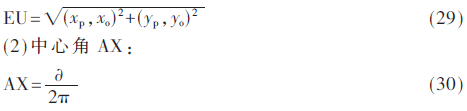
5 GGO型結節特征選擇及分類算法
特征選擇[13]就是從特征集中挑選能準確地區分肺結節和其他組織器官的最佳特征組合,本文應用遺傳算法選擇特征值,根據最佳特征組合去除錯分的肺結節,把選擇好的最佳特征組合值放入SVM分類器進行訓練,提取出更精確的肺結節。圖2給出特征選擇的框架圖。

最后把最佳特征組合放入SVM分類器中訓練,訓練的算法過程為:(1)繪制結節區域的灰度圖;(2)提取結節的特征值;(3)設置特征維數I(1~9);(4)根據維數選擇特征組合;(5)將組合值代入SVM分類器進行運算,得出參數值;(6)繼續對訓練樣本進行檢測,得出特征組成的檢測率;(7)檢測是否為最佳的特征組合,若是,則結束;(8)特征維數I=I+1,繼續選擇最佳特征組合,重復步驟(1)。
6 實驗結果與分析
6.1 實驗數據
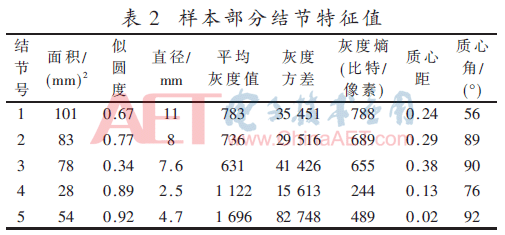
實驗數據來源于LIDC(Lung Image Database Consortium)數據庫,從數據庫中隨機選取40張病例影像CT圖像。影像數據圖像里共含有結節229個,經過篩查,包含粘連血管型結節有69個,孤立型結節90個,毛玻璃型結節有42個,肺壁型結節有28個,結節的直徑在3 mm~30 mm之間,毛玻璃型結節是本實驗要檢測的結節,樣本的部分結節的特征值如表2所示。
6.2 實驗環境
本實驗所有數據是在Windows 7、主頻2 GHz、內存4 GB的計算機配置上完成的,編程軟件為MATLAB2012,開發平臺是在NIL庫下實現的。
6.3 實驗結果
圖3給出了利用形狀指數提取GGO型結節的過程。圖4給出了利用閾值法提取剩余結節的過程,圖4(d)圖中黑色圈標注區域即為提取的GGO型肺結節。
對于實驗數據及算法的評價,通過敏感性和特異性來評估實驗結果。敏感性(Me)[14]:算法能否把金標準指定的結節全部檢測出來,有多少漏檢情況。特異性(Te):根據金標準,能否把不是結節的判斷出來,有多少誤檢情況。敏感性值高,漏檢的少。特異性值低,誤檢率低。定義TP為檢測出真結節的個數,即真陽性;FN為沒有檢測出真結節的個數,即假陰性;TN為檢測不是結節的個數,即真陰性;FP為檢測出假結節的個數,即假陽性。定義公式如下所示:

根據結節的“金標準”區域,按照如下3個準則統計該算法的敏感性和特異性,共檢測出42個毛玻璃型結節中的39個結節,檢測的敏感性達到92.8%時,特異性達到15.6%。
去除假陽性結節后,把最佳特征組合放入分類器中,提取出肺結節,本文的算法與現有的文獻[3]以及文獻[5]的方法相比,結果如表3所示,該算法在性能上都有所改進。

6.4 實驗分析
本文提出的分兩階段檢測毛玻璃型結節的算法,從檢測性能上來看,效果比現有的方法要好。應用形狀指數檢測GGO型結節,其中閾值的選取對結節檢測的敏感性和特異性影響比較大。圖5繪制了受試者工作特征(ROC)曲線圖[15],以假陽性率(FPS)表示橫坐標,以真陽性率(TPF)表示縱坐標。從曲線圖可以得知,閾值取0.88~0.91之間,敏感性達到最大,即漏檢的結節數最少。

7 結論
在分析了GGO型結節的特征后,在現有方法的基礎上,提出了一種提取GGO型結節的新方法。該方法主要針對4 mm~30 mm的肺結節進行檢測,首先檢測類球型肺結節,再用濾波器增強的閾值法檢測非球型肺結節。兩個部分相結合,降低了結節的漏檢率。接下來提取結節的部分特征,通過遺傳算法進行特征選擇。最后,根據最佳特征組合去除假陽性結節,利用SVM分類器識別出GGO型肺結節。
從LIDC數據庫中下載100張CT圖像來評估本文的算法,在檢測敏感性達到92.8%時,特異性為15.6%,評估結果表明本文的方法能較好地提取出GGO型肺結節。
參考文獻
[1] 楊瑞森.肺癌流行病學和早期診斷新技術[J].腫瘤防治雜志,2011,11(7):745-748.
[2] 賈同,魏穎,趙大哲.一種基于CT影像的肺癌病灶檢測新方法[J].電子學報,2010(11):83-87.
[3] MAEKADO M,KIM H,ISHIKAWA S,et al.Automatic extraction of ground-glass opacity on lung CT images by histogram analy sis[C].International Conference on Control,Automation and Systems,2013:2352-2355.
[4] KATSUMATA Y,ITAI Y,MAEDA S.Automatic detection of GGO candidate regions employing four statistical features on thoracic MDCT image[C].International Conference on Control,Automation and system,2007.
[5] ZHOU J H,CHANG S,METAXAS D N,et al.Automatic detection and segmentation of ground glass opacity nodules[C].Medical Image Computing and Computer-Assisted Intervention MICCAI,2006,4190:784-791.
[6] 曹蕾,占杰,余曉鍔,等.基于自動閾值的CT圖像快速肺實質分割算法[J].計算機工程與應用,2008(12):182-185.
[7] 翟志偉.基于CT圖像的肺部腫瘤檢測與診斷[D].哈爾濱:哈爾濱工業大學,2015.
[8] 孫明磊.基于肺部CT圖像的肺結節自動檢測與識別[D].上海:華東理工大學,2012.
[9] 王青竹.基于三維SVM的肺部CT中的結節檢測算法[D].長春:吉林大學,2011.
[10] 林紅利.基于CT影像的肺結節病變計算機輔助診斷關鍵技術研究[D].長沙:中南大學,2011:76-78.
[11] ARMATO S G,ALTMAN M B,WILKIE J.Automated lung nodule classification following automated nodule detection on CT:a serial approach[J].Medical Physics,2013,30(6):1188-1197.
[12] 孫申申.基于影像的肺結節檢測與分割方法研究[D].沈陽:東北大學,2009.
[13] 張立蘭.基于數學形態學的組織切片細胞圖像分割算法的研究[D].錦州:遼寧工業大學,2015.
[14] NAKAMURA Y,FUKANO G,TAKIZAWA H.Eigen nodule: view-based recognition of lung nodule in chest x-ray CT images using subspace method[C].Proceeding of the 17th International Conference on Pattern Recognition(ICPR'04),2004:1051-4651.
[15] 賈同,孟琭,趙大哲,等.基于CT圖像的自動肺實質分割方法[J].東北大學學報(自然科學版),2008(7):55-57.

